美國仿製藥中專利挑戰的商業價值和商業策略(一)
文章發表:2017/08/08
导读:“挑战专利不是技术问题,也不是法律问题,它是一种商业策略”


一.原创药的专利保护与仿制药的专利挑战
1.新药开发的反摩尔定律与药物专利的翘尾效应
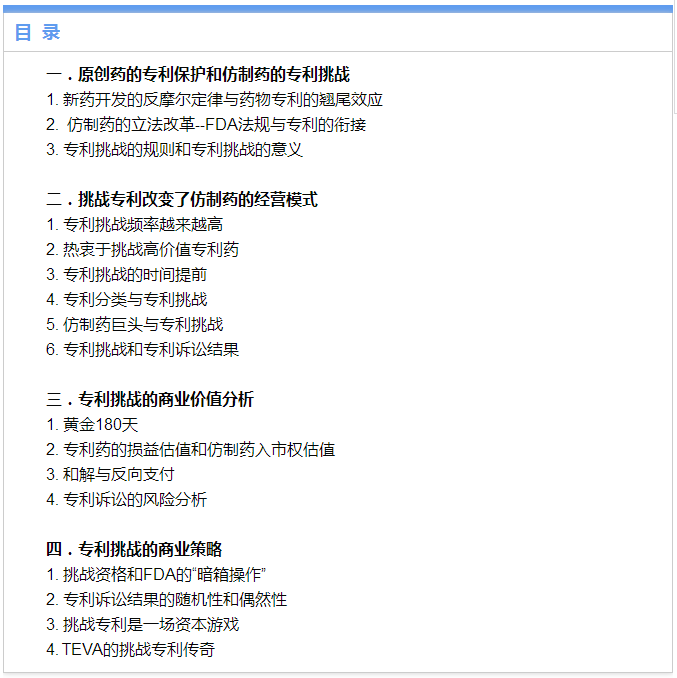
众所周知,新药研发是一种大资金,长时间,高风险的投资。在美国FDA注册的近2000家制药公司,只有不到50家是新药主导型药物公司,其他的均为仿制药公司。新药开发具体的过程和风险本文不做论述,现仅就资金投入的回报做一简单的分析。在现代科学技术领域有一个很著名的“摩尔(Moore)”定律,即某项技术的指标在单位时间内的变化。以芯片技术为例,当价格不变时,集成电路上可容纳的元器件的数目,约每隔18-24个月便会增加一倍,性能也将提升一倍。但是,在从上世纪50年代开始,制药工业新药开发投入回报比却走出一条“反摩尔(Eroom’s)”定律曲线,即:每10亿美元上市新药的数目,每10年向下翻一番。上世纪60年代,投入10亿美元可以上市大约10个新药,到了本世纪初,仅能收获1个新药,2016年平均10亿美元已不足一个新药的开支了。
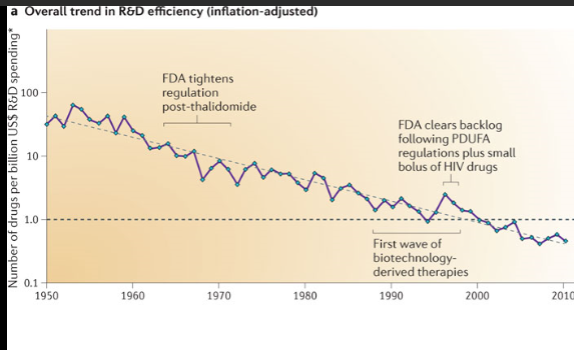
目前,美国每上市一个新药的成本在18-20亿美元之间。有人认为,到2025年,这一数字有可能达到50亿美元。如此巨大的投入,怎样收回投资,怎样赚取利润?专利就成了制药商们唯一可以依仗的利器。原创药主导的制药企业面临的问题是:FDA批准一个NDA,少则5年8年,多则10年20年,占去了有效专利期的大部分时间。这就迫使药物开发商必须在FDA批准NDA上市后的剩余专利保护期内收回投资、赚取利润。因为一旦专利到期,仿制药就会蜂拥而入,就会有所谓的“专利悬崖”。可见,专利即为原创药的身家性命。就药物专利的价值而言,药物专利与其他专利截然不同。
一般的工业专利由于新技术的出现,往往在专利尾期的专利已经没有价值。而药物专利由于研发和FDA审批占用了大量的专利时间,往往新药上市后,专利剩余期所剩无几,就形成了“专利翘尾价值”。就是说,一个专利药物的专利越接近尾端,其价值越高!因此,原创药从药物设计到药物上市,贯穿始终的“市场独占期(Market Exclusivity Period MEP)管理”无不围绕着专利申请和专利保护展开。从“核心”专利,到“延伸专利”,直至所谓“流氓专利”,目的就要强化专利的专利性,延长专利保护期。
美国杜克大学的Grabowski在2015年统计了从1996年到2012年上市的美国专利药的平均MEP,(即从FDA批准NDA到仿制药入市之间的时间),为13.4年。而年销售额10亿美元以上的所谓“巨弹药物”(Block buster)的MEP只有12.4年。用10年左右的市场独占期,收回10-18亿美元的上市投资,还要赚取利润,高价格成了唯一的选择,“专利翘尾价值”也是商场法则的使然。这也是后文将要分析的专利药“高损益估值”根本原因所在。
2.仿制药的立法改革--FDA法规与专利的衔接
1984年,专利药和仿制药有关专利保护合法性和合理性的争论发展到了极点。专利药认为FDA的法规审查过于复杂,费力、耗时,消耗了原创药投资的80%,占用了8-12年的专利保护期。等你FDA批准NDA入市,要么专利已到期,要么还有2-3年的专利保护,专利还有何用?药价焉能不贵?仿制药也是怨声载道:仿制药的审批程序和原创药一样,已经上市了十几年的药物,为什么要仿制药重复原创药花费极高的临床研究?FDA要等到专利到期才接受仿制药申请,一审就是3年5年,无端地增加了3到5年的专利保护,凭什么?1983年150个专利药专利到期,居然无人仿制!
1982年,里根入住白宫,推出医保改革方案,急需廉价药物入市。美国各个政治利益体的矛头所向:FDA。Bolar和Roche的专利侵权案成了美国仿制药立法改革的导火索。1984年美国国会就仿制药立法举行了听证和辩论,试图在“鼓励新药研发投入和放水仿制药入市”之间找到平衡点。最后国会通过了美国议员Hatch和Waxman提出的《药物价格竞争和专利期补偿法案》。也有人称之为“现代仿制药法案”。

该法案的点睛之笔有三点:
- 重新定义“仿制药”,建立简约新药申请(ANDA)制度,使仿制药成本真的做到了“廉价”,使仿制药的入市真的做到了“快速”。用生物等效BE,药学等效PE,治疗可替代TE的新观念取代了繁琐的临床实验“仿制”。
- PIV专利挑战制度的建立,动摇了专利对药物的刚性保护,开启了仿制药可以挑战专利的公平竞争。把仿制药在专利期内的入市的裁决权交给了法院。
- 通过数据独占期和专利期补偿弥补新药上市期间由于FDA法规审批所占用的时间。
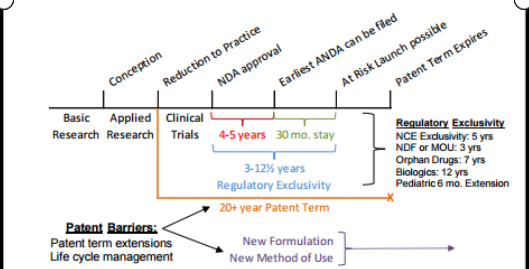
该图更加凸显了专利在保护新药价值和抵御仿制药入市中的重要作用。
该法案实施30多年来,美国的医药市场发生了如下变化:
- 1984年,美国仿制药在处方药中的占有率为20%,2016年这个数字接近95%。
- 原创药的平均专利保护时间延长了3年。
- 仿制药的平均入市时间提前了3年。
- 新药研发投入资金的回报率降低了约12%。
3.专利挑战的规则和专利挑战的意义
(1)专利挑战规则:
按照PIV挑战规则,仿制药在向FDA提交ANDA时要对标的药物(RLD)在橙皮书所列专利的所有专利做出专利状态说明。专利状态分为4类:
- ParagraphI:没有专利
- ParagraphII:有专利,但专利已过期
- ParagraphIII:有专利,但仿制药申请不寻求在专利期内上市
- ParagraphIV:有专利,但仿制药申请不侵犯专利,或专利无效
当提交ANDA附有Paragraph IV证明时,即视为专利侵权。ANDA申请人要在20天内通知专利权人,专利权人在45天可以向法院起诉ANDA侵权,并通知FDA。FDA则自动停止该ANDA审核30个月。如果仿制药胜诉或和解,并获得FDA批准上市,该ANDA(FTF)可以享有180天的仿制药市场独占期。
(2)专利挑战的意义
药物专利的特点之一是:只有FDA批准该药物上市,其专利才体现价值。FDA只审查ANDA的药物药效学的合规性,而不对药物所涉及专利的专利性进行审查。但是,在FDA法规和专利的衔接中,FDA会自动把有专利争议的ANDA排除在市场之外。换言之,如果不设置PIV专利挑战的话,只要有专利存在,ANDA就只有等到专利到期才能上市。如果专利本身就是无效专利,或者ANDA没有侵权,为什么不能在专利期内上市呢?何况由于制药行业的“反摩尔定律”和“专利翘尾价值”,仿制药早一天入市,意味着巨大的经济利益。
从专利法理的角度,普通专利并不具有阻止“侵权”行为发生的功能,只有在“侵权”行为发生后专利权人才能启动法律程序追索“侵权”损失,并要求停止“侵权”行为;而按照FDA的ANDA申请规则,药物专利可以阻止“侵权”行为发生。因为在橙皮书所列专利的有效期内,FDA不会批准相应的仿制药入市,这样,FDA的法规就阻止了“侵权”行为的发生。这在专利法理上是“悖论”(after the fact and prior to fact)。设立PIV专利挑战从法律上规定:提交PIV证明即视为“侵权”发生,这种“视为侵权”就可以启动法律诉讼,以此弥补了FDA法规和专利法衔接中的缺陷。
从药学经济学的角度,正是由于FDA批准NDA上市,才赋予了相应专利以商业价值。如果没有NDA上市,专利本身也没有价值。FDA给予专利价值,却又不对专利内容的真实性和专利性负责。于是,有人提出了“NDA专利价值再审计”的问题。NDA想维持高价格,就要接受竞争者的专利挑战,只有在专利诉讼中胜出,才能证明专利的专利性。1984年仿制药立法改革建立了专利挑战制度,并将180天的市场独占权作为对挑战者的鼓励和奖励。没想到的是,这180天竟然使得仿制药对挑战专利蜂拥而至,成了美国仿制药的主要利润来源。
由于药物开发的特殊性,从药物专利的撰写、申请、审查和使用来看,专利瑕疵也是可能的。所以“高价值的药物不一定有高质量的专利,但是挑战高价值的药物专利会为你提供获得高回报的机会”。
二.挑战专利改变了仿制药经营模式
在1984年仿制药立法改革之初,专利挑战并没有引起仿制药的足够兴趣,挑战者寥寥无几。1993年到1998年,FDA仅批准了3个专利挑战。究其原因,还是立法不够严谨。不但规定挑战者只有赢得专利诉讼才能获得首仿(First-to-Filer,FTF)180天独占权,而且对30个月遏制期也不加限制。于是,原创药采用专利延伸、专利池等方式给挑战者制造困难,使其不断应对新的专利诉讼,不断有新的30个月遏制期,故无法得到180天独占权。1998年和2003年对仿制药立法和专利挑战的规则又做了相应修改。例如,在1998年Mova侵权案中,法院驳回了FDA的PIV挑战专利诉讼胜诉原则。至此,不起诉,胜诉,和解都可以得到180天独占权。2003年的MMA法案做了多项有利于仿制药的改革:规定了多个FTF共享180天,只有一个30个月遏制期,只有一个专利延期等等。从1998年之后,不但专利挑战逐年增加,挑战的频率越来越高,仿制药的胜诉比例也更加明显,于是挑战专利成了仿制药的主要盈利模式。下面用图表说明专利挑战改变仿制药业态的过程。
1.专利挑战频率越来越高
图3.引自2013年的美国《医学经济杂志》,该图描述了1995年到2012年新分子(NMEs)药物PIV挑战的统计。新药专利被挑战的比例从1995年的9%上升到2012年的82%。
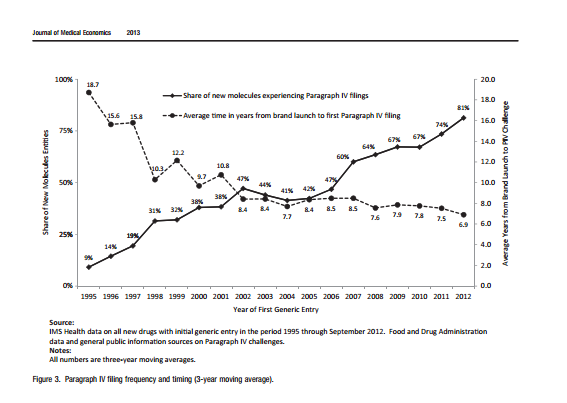
资料来源:《Journal of Medical Economics》2013
2.热衷于挑战高价值专利药
高价格药物不一定有高质量的专利,但是挑战高价格药物可以得到高额回报。下表.给出Grabowski统计的1984年到2012年不同市值专利药物的专利挑战情况:年销售5亿美元以下药物挑战率为45%,5亿美元–10亿美元药物的挑战率为81%,超过10亿美元的巨弹药物为91%。
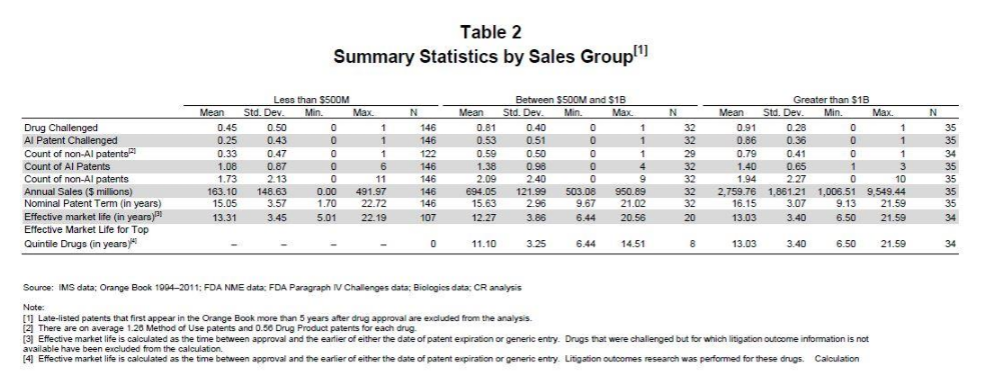
资料来源:AEA Conference Boston,Massachusetts January 4,2015
3.专利挑战的时间提前
随着挑战专利的不断获利,仿制药的挑战时间大幅度提前,NCE-1仿制药申请制度被用到了极致,甚至有的挑战者将专利挑战的准备提前到了NDA的Phase II或Phase III阶段。
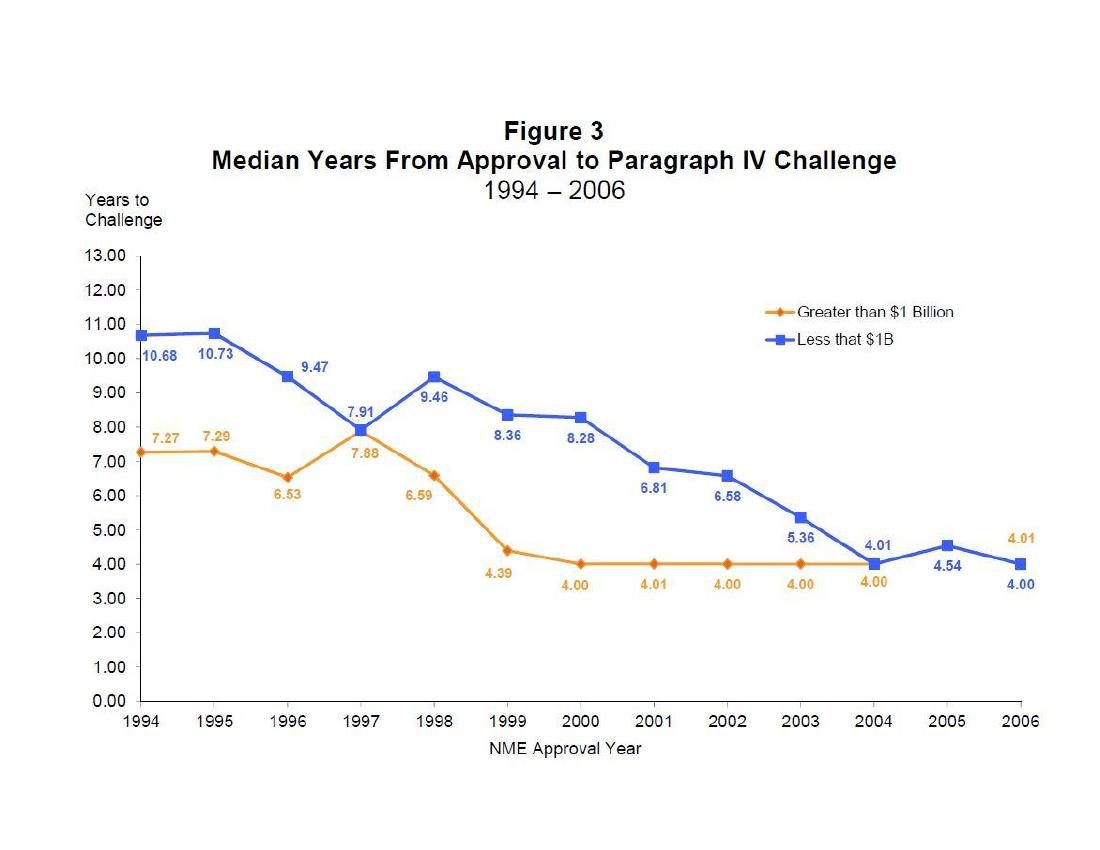
资料来源:AEA Conference Boston,Massachusetts January4,2015
图中可以看出,自2004年之后几乎所有的挑战都发生在规定时间的起始点(NCE-1,第4年结束)。换言之,现今的高市值原创药,一旦失去FDA的数据独占期,只要还有专利剩余期,几乎无一例外地遭到专利挑战。更有文献提及,某些挑战者在IND提交后,就设法通过反向工程法仿制NDA,在NDA的PhaseII或PhaseIII阶段就做生物等效实验。
4.专利分类与专利挑战
图5.AI专利挑战和挑战总数之比
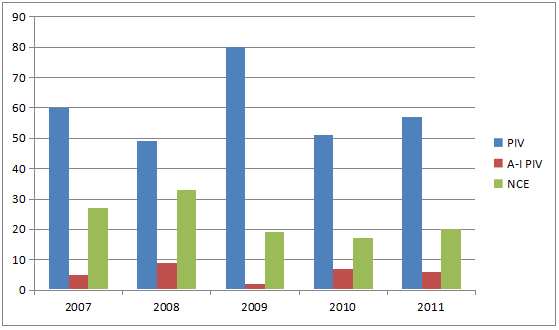
资料来源:《Newport Premium》2012
化合物专利是药物专利的“强”专利,而在橙皮书登记的绝大多数专利是非化合物专利。图5给出在2007年到2011年的PIV专利挑战中化合物专利与挑战总数之比。原创药的专利延伸和专利池策略,也造就了很多非化合物专利在FDA橙皮书登记。非化合物专利是专利挑战的很好的标的:为回避化合物专利,仿制药常采用化合物专利提交PIII,非化合物专利提交PIV的策略。
图6.给出了FDA橙皮书中专利分类示意图

资料来源:AEA Conference Boston,Massachusetts January4,2015
5.仿制药巨头与专利挑战
全球仿制药巨头-TEVA制药完全是靠挑战专利起家的制药商。TEVA、Mylan等五家仿制药公司占据了美国仿制药市场的50%。图7.给出了仿制药巨头2008-2011四年的专利挑战统计
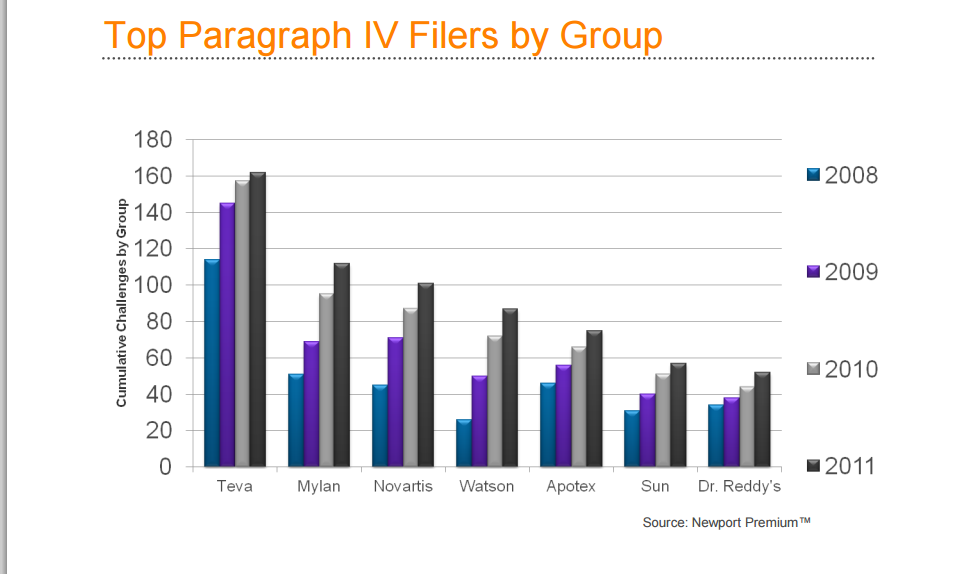
资料来源:《NewportPremium》2012
6.专利挑战和专利诉讼结果
专利诉讼的结果表明:仿制药在诉讼中有着明显的优势。2002年美国联邦贸易委员会(FTC)应美国国会的要求,向国会报告仿制药立法改革的实施效果。FTC的报告中给出了104个专利诉讼案的诉讼结果统计(图8)。
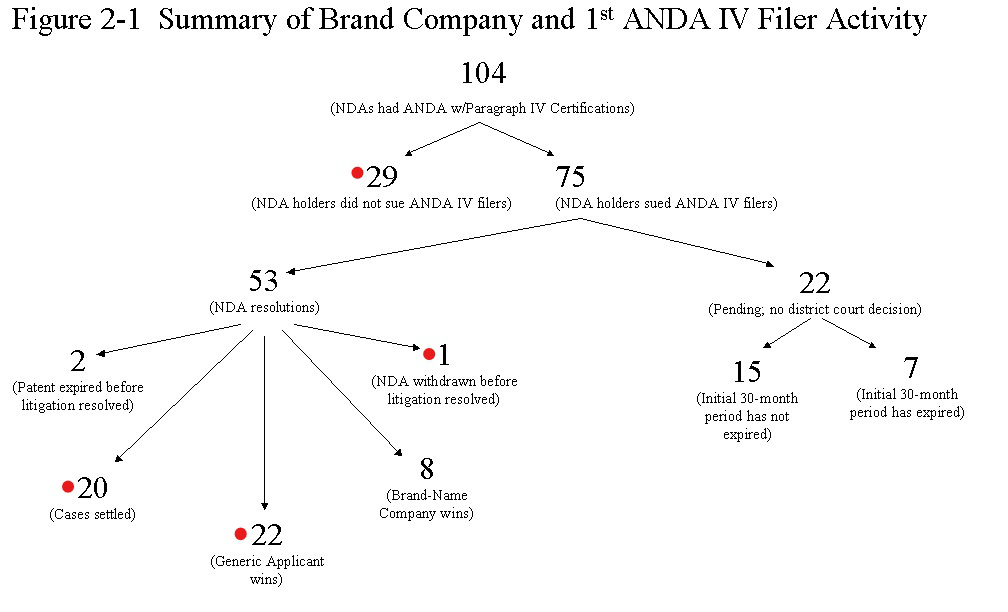
资料来源:《Generic Drug Entry Prior to Patent Expiration:An FTC Study July 2002》
其中:没有起诉29个,仿制药胜诉22个,和解20个,撤诉1个,专利药胜诉8个,仿制药获胜合计72个。另外22个属于未结案。
Grabowski统计了1994年到2006年高价值专利药的诉讼,并且按照专利分类对诉讼结果进行了统计(图9):
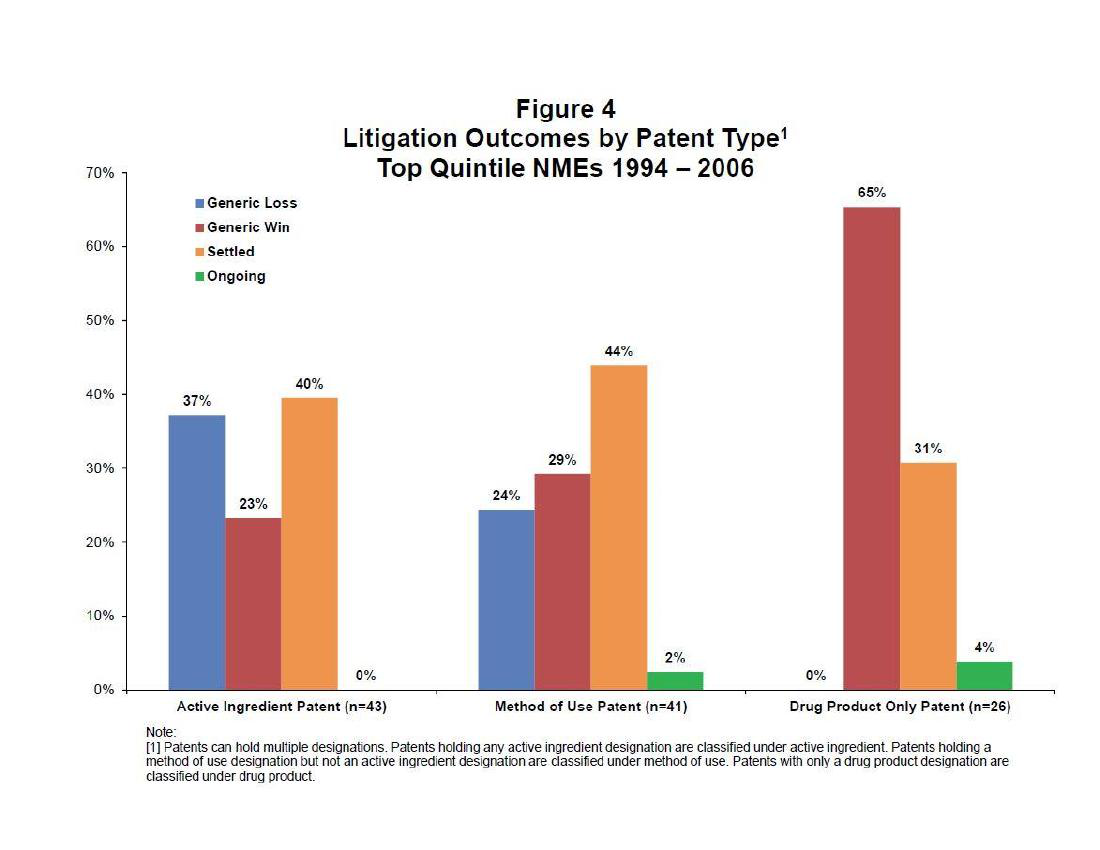
资料来源:AEA Conference Boston,Massachusetts January4,2015
- 43例化合物专利:专利药胜37%,仿制药胜23%,和解40%;仿制药和解+胜诉为63%。
- 41例用途专利:专利药胜24%,仿制药胜29%,和解44%;仿制药和解+胜诉合计73%。
- 26例制剂专利:专利药胜0,仿制药胜65%,和解31%,仿制药合计96%,4%未结案。
这就是本文所反复强调的:专利诉讼赢在法律的平均机会。专利诉讼中和解是明显有利于仿制药的结果。因为和解除了可以给于仿制药更高的赔付之外,还可以延迟或阻止其他竞争对手进入,是一种原创药和首仿仿制药双赢的局面。
从以上图表中可以得出结论:美国仿制药的法规鼓励挑战专利,专利诉讼中仿制药的胜率很高,药物的价值和专利难度没有必然的关系,很多非化合物专利是很好的挑战标的,专利挑战是仿制药强者的经营模式。
- 資料來源:药智网
- 作者:孟八一









